【内容提要】:该文通过阐述相关hr-HPV宫颈感染与宫颈癌发生的科学问题研究现状,以及中国宫颈癌“三阶梯筛查”的困境,展开评述第一阶梯TCT筛查的问题以及在人口大国难以施展覆盖面达全女性人口的80%,以及现阶段hr-HPV检测在“三阶梯”筛查模式中的角色,指出适龄人群接种宫颈癌预防性疫苗(即HPV疫苗)后也不能终止宫颈癌的筛查值得关注问题,推介WHO倡导的新技术发展可以更全面的预防和控制宫颈癌及其观点,提出了推进hr-HPV宫颈感染 “男女性伴同防同治”是弥补宫颈癌防治的重要环节的专家观点。
【关键词】:宫颈癌筛查,宫颈病变,hr-HPV,三阶梯筛查,HPV疫苗,清除hr-HPV,男女性伴,同防同治。
【引言】2020年11月1日零时为标准时点对31个省(自治区、直辖市)开展了第七次全国人口普查,2021年05月10日普查公报1-8号全文公布,全国人口共14.1178亿人,与2010年第六次全国人口普查数据的13.3972亿人相比,增加7206万人,增长5.38%,年平均增长率为0.53%。男性人口为7.2334亿人,占51.24%;女性人口为6.8844亿人,占48.76%。总人口性别比(以女性为100,男性对女性的比例)为105.07,与2010年基本持平,略有降低。根据这一数据依宫颈癌筛查的适龄女性人口70%计算,每年约有4.8亿的女性需要接受宫颈的防癌筛查。若每年筛查1.0亿女性,则需要4.8年才能完成一轮筛查,若每年筛查4800万女性人口,需要10年才能在全区域内完成全适龄女性人群的筛查。现阶段中央到地方两级财政支持的全国及省市地县乡的区域性筛查规模,近10余年来累计覆盖规模仅为正常适龄女性人群的10%-20%,筛查规模难以覆盖全区域全正常适龄人群。各地区因经济水平参差不齐,决定筛查的间隔频率不同!有1次/年、1次/2年或1次/3年不等。而且有动员参加筛查人群相对稳定的趋势,新增规模覆盖的人群有限。近年来倡导用HPV检测手段在正常适龄女性人群中实行首/初筛,本意是弥补TCT筛查的困境和缺憾,但事实上该方案只是检测出正常人群中hr-HPV感染状态或称易感人群,并不能筛查出子宫颈的病态。HPV单纯1次HPV检测阳性也不代表持续性感染!也不是诊断宫颈病变的治疗标准!况且hr-HPV检测阳性致患者恐慌,医务人员自己感染hr-HPV也会有不同程度的畏惧心理。实际上造成过度诊治50-90%感染hr-HPV女性的宫颈病变!医务人员在处置hr-HPV宫颈感染者时,也对约90%感染hr-HPV者能在24个月内自动清除持有疑虑,而有过度处置的倾向!
一、hr-HPV宫颈感染与宫颈癌发生的科学共识
近90%的SIL和99%的宫颈癌组织中发现高危型HPV感染,其中70%与HPV16,18相关。高危型HPV产生病毒癌蛋白,其中E6和E7作用于与宿主细胞的抑癌基因p53、pRb使之失活降解,继而通过一系列分子事件导致癌变[1]。hr-HPV宫颈感染是宫颈癌发生的元凶。接种HPV预防性疫苗可实现子宫颈癌的一级预防[1]。男女性交不是hr-HPV宫颈感染的唯一方式,HPV不通过血液、体液或精液传播,会阴部皮肤接触是hr-HPV感染必要的且最有效的性传播条件[2]。HPV病毒感染的特点:①至今HPV只发现在人体上皮组织传播,其感染形式不伴有炎症表现,肉眼往往无法观察是否HPV感染;②HPV不能/易体外培养和做体内动物实验模型;③HPV不进入血液循环系统或体液;④全身系统用药不是最佳的治疗方式;⑤在人的皮肤及上皮细胞基底层复制、表达,要求药物必须具备良好的透皮吸收性能才可能发挥作用。
相对宫颈癌和高级别病变的发病而言,其特点是HPV感染的发生率高,宫颈高级别病变的患病率低。一项简单的临床模型设计,基于美国人群一生中的性伴侣数量和每一对伴侣感染HPV的概率,评估在未接种HPV疫苗的情况下,美国人口一生中感染HPV的概率很高,研究显示,美国人群中有性行为的男性和女性一生感染HPV几率高达85%-90%,大多数感染可以被自身清除[3],小部分患者hr-HPV持续感染,可导致病变并最终进展为宫颈癌 [4]。
绝大部分的hr-HPV宫颈感染者依赖自身的免疫功能可以自动清除感染的hr-HPV。尤其是<30岁的女性,因此,国际公认的宫颈癌筛查策略<30岁的女性以TCT筛查结果为主,≧30岁的女性则应该接受TCT和HPV双筛。在宫颈炎至宫颈病变的发展过程中,相当一部分病变会逐渐退回到正常范围或“原地踏步”保持癌前病变级别不变,这取决于宫颈感染hr-HPV女性的自身免疫机能高低(如图所示)。但值得注意的是一旦进入CIN3及以上的病变就不能退回到正常或低级别病变了,应积极干预治疗。
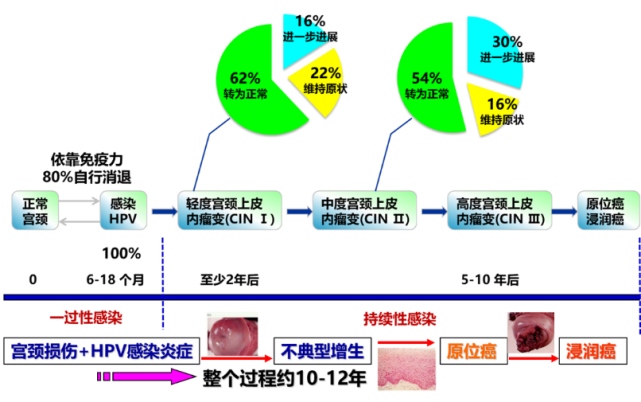
总体来讲,正常人群自动清除率可高达90%,仅仅10%的女性会持续性感染,大约十年以后,至30年可能有50%的hr-HPV宫颈持续感染者罹患≧CIN3的病变,另50%的CIN3病变持续存在或渐渐消退(如图所示)。
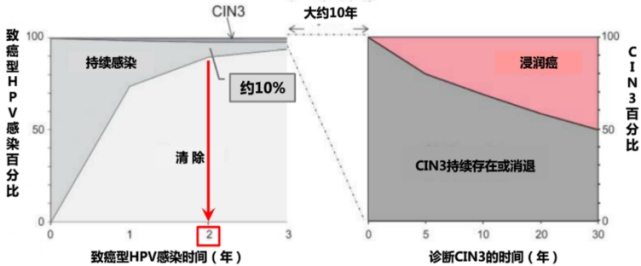
如果是hr-HPV-16型或hr-HPV-18型宫颈感染,处理起来就应该更积极一些,因为它们较其它型别的hr-HPV宫颈感染,在同样的时间内发生高级别病变的比例更高。即持续存在十年后≧CIN3的病变分别为17.2%(11.5~22.9)和13.6%(3.6~23.7)。如遇这类女性应更加积极干预处理,尤其是已经完成生育计划者。
二、hr-HPV检测在“三阶梯”筛查模式中的尴尬局面
我国在hr-HPV宫颈感染与宫颈癌防控的模式中,采用hr-HPV检测到底应该是作为全区域内全正常人群的初筛措施,还是作为“三阶梯”筛查模式的分流手段?当前制订的宫颈癌筛查专家共识或指南,是否可以定义为医疗机构对区域内适龄女性,寻求宫颈病变和宫颈癌发生早诊早治的机会性分流排查方案?由于hr-HPV检测和“三阶梯”筛查都未能理想的解决全区域内全适龄人群的普查普筛的问题,令广大临床医生陷入困境而感到无奈。
借鉴国际上认同的“三阶梯”筛查模式不适合在幅员辽阔的人口大国,进行全区域内全正常适龄人群一个不少、一个不漏、一个不掉的筛查国情。这是因为①每轮筛查人数应达4.8亿。地区间经济发展和医疗资源配置水平参差不齐,差异巨大。筛查普及教育,难以大面积推广达到预期结果,百姓难有较好的获得感!②“三阶梯”筛查方案推的广应用与区域内医疗资源和正常适龄人群需求不相匹配。病理专业注册医师不足1万人,加上病例技师也仅3万人左右。专门从事细胞病理学诊断的医师奇缺,分子生物学和细胞生物学替代筛查方法昂贵,方法需专人专项操作,培养学习时长。③每轮新增筛查人群比例低,可疑阳性人群因常因经济拮据,复诊随访脱失率高。④中心城市医疗机构支援偏远地区的筛查方法效果不佳。靠中心城市的医疗机构依深入支援基层乡镇卫生医疗机构,或偏远城市社区卫生医疗机构的方法,人力资源不足,资金支持难以为继,实施全区域正常适龄人群的全覆盖筛查有困难。⑤大型医疗机构、学术团体、社会“慈善”组织、民营医院联合企业产品以及第三方检测机构组织实施或提出新的多元化筛查方案,实际上是无序化,甚至是多元恶化。⑥拟以HPV检测手段替代三阶梯在正常适龄人群中推行的初筛,hr-HPV检测阳性既会引起患者恐慌,也使医务人员自身心理畏惧。⑦hr-HPV阳性检测结果仅表示易感人群的感染状态,不代表宫颈病变级别。笔者认为“目前推荐的筛查指南只是适合在有条件的医疗机构,实际上推行的是区域内正常适龄人群的机会性排查,以hr-HPV检测作为分流,不是真正意义上的筛查。”
三、适龄人群接种防性HPV疫苗后不能终止宫颈癌筛查
即使接种了宫颈癌预防性疫苗(HPV疫苗)的所有适龄女性,也不应终止宫颈癌的筛查,这个问题值得关注。2002年至2017年世界卫生组织(WHO)发布了一系列宫颈癌防控相关文件。2002年和2006年的《发展中国家的宫颈癌筛查》[5,6],2011年《引入HPV疫苗的准备:政策与方案指南》[7]和《WHO指南:使用冷冻法国家治疗宫颈上皮内瘤变》[8],2013年《WHO为预防宫颈癌的筛查和治疗癌前病变的指南》[9] ,2014年《宫颈癌综合防治基本实践指南(第二版)》[10],以及2014年和2017年《HPV疫苗WHO立场文件》[11,12] 。倡导为女性健康投入更多的关注和资源,不仅致力于解决孕产妇保健和计划生育问题,同时积极参与卫生系统建设,通过不断研发、测试和实施新的技术,使宫颈癌护理在低收入和中等收入国家变得可行和可负担。新技术的发展可以更全面的预防和控制宫颈癌,并为全球女性建立一个更健康的未来[9]。WHO的文件谈接种宫颈癌疫苗的群体免疫立场的内容较多,而涉及清除宫颈感染hr-HPV的建议及共识较少。
首支HPV疫苗2006年在全球上市之后,陆陆续续上市的HPV疫苗产品共有三种,分别是二价疫苗、四价疫苗、九价疫苗。自上市以来最早应用的HPV疫苗至今已经14年了。我国家是在分别2016年、2017年和2018年批准上市了进口的二价疫苗、四价疫苗、九价疫苗,自主研发法的国产二价疫苗于2019年上市,实际上现在已有4种HPV疫苗应用于中国适龄女性群体。
二价疫苗产生的抗体可以对抗中和hr-HPV16和hr-HPV18,其预防宫颈高级别病变和宫颈癌发生的效力可达70%。二价疫苗有进口疫苗和国产疫苗两种提供给适龄女性。国产(二价)疫苗有一个特点,对于9~14岁的女性可以接种两剂,达到与三剂一样的效果。
四价疫苗产生的抗体可以中和对抗两个lr-HPV6和lr-HPV11,预防两个低危型HPV感染所致的生殖器尖锐湿疣,这两个低危型HPV的感染实际上与90%的尖锐湿疣相关;另外仍可中和对抗hr-HPV16和hr-HPV18两个高危型HPV感染所致的宫颈病变。在我国临床试验中由于尖锐湿疣的病例很少,不足以获得其对生殖道尖锐湿疣有预防效果的相关大数据。但它与二价疫苗一样对hr-HPV16和hr-HPV18感染,导致高级别宫颈病变和宫颈癌, 同样可以达到70%以上的预防效果。
九价疫苗是包含HPV6/11/16/18/31/33/45/52/58九个型别的壳基因重组蛋白疫苗,2018年在我国CFDA获得有条件上市许可,当时在国内并没有III期的临床数据,是根据四价疫苗在中国的临床试验,以及在东南亚地区,包括中国香港和台湾地区的黄种人接种临床试验批准上市应用的。现正在进行九价HPV疫苗的III期临床试验。根据这些数据批准其可用于16~26岁的女性,可预防90%以上的高级别宫颈病变和宫颈癌。
值得关注的是不论哪种疫苗都包含了hr-HPV16和hr-HPV18两个高危型HPV感染预防,价数多的还包括了常见的hr-HPV31型、hr-HPV33型、hr-HPV45型、hr-HPV52型和hr-HPV58型,接种后所产生的抗体间都有交叉的免疫防护作用。适龄女性接种HPV疫苗均可从中获益,但不容忽视的是不论接种了HPV疫苗与否,仍需接受例行的宫颈癌筛查。因为这类疫苗都是根据HPV壳的晚期基因L1和L2研发的,不含HPV核基因的预防性疫苗。由于HPV不能体外培养,目前也没有成功的动物模型实验结果,更没有杀灭HPV的药物试验结果。所以,对于宫颈感染HPV的女性,帮助其清除生殖道内的HPV是宫颈癌防治的重要环节。直到出现根据HPV核的早期基因E6和E7等研制出治疗性HPV疫苗,才算取得宫颈癌防治的重大进展。
四、“男女性伴同防同治”是宫颈癌防治的重要环节
2017年中华预防医学会妇女保健分会出版的中国《子宫颈癌综合防控指南》,提出子宫颈癌综合防控的三级预防策略[13]。一级预防即对适龄男女开展安全性行为教育,如推迟初次性行为年龄、减少高危性行为,促进安全套使用,禁烟,包皮环切等,并对适龄女性接种HPV疫苗;二级预防对25岁及以上女性进行子宫颈癌筛查、癌前病变的诊断和治疗,包括定期开展子宫颈癌筛查、尽早物理和电切治疗、接种过HPV疫苗的女性仍需接受定期筛查;三级预防治疗子宫颈浸润癌的女性,包括手术、放化疗和姑息治疗措施。但并未阐述帮助hr-HPV宫颈感染的女性及时清除病毒这一重要环节。
1.幅员辽阔筛查措施及全面接种预防性HPV疫苗难以覆盖全正常适龄女性
我国宫颈癌筛查的适龄女性人数,占48.78%人口总数的70%,约为4.8亿。按筛查数据约10% 的HPV感染率,共约4800万女性罹感HPV感染,其中若10%的女性为持续感染者,即有480万女性为高危人群。这个数字相当于我国辽宁省的人口数、2014年乌克兰的人口数、美国的移民人数。HPV感染业已造成的这么大基数的人口恐慌,又没有解决问题的具体方法,着实令人担忧。
2.HPV感染属性传播感染“男女性伴同防同治”是经典有效的方法
泌尿生殖系统疾病的夫妻同治概念是由美国著名性学权威大师马斯特和约翰逊夫妇在20世纪70年代初提出的。曾流行于欧美等国,是国际上公认有效率较高的性传播疾病治疗方法。临床常见用某治疗方案使hr-HPV转阴的女性,一段时间后又出现新型hr-HPV感染或同型hr-HPV复发。JAMA基于群体男性HPV感染的研究发现[14],男性总体生殖器HPV感染率高达45.2%!而≥1种高危HPV亚型感染率为25.1%。男女性伴交互感染是导致宫颈hr-HPV持续感染最有效的条件。
3.宫颈感染HPV在男女性伴间交互式传播造成女伴持续性感染在所难避
女性宫颈感染hr-HPV的男伴应视为hr-HPV感染高危人群。一项关于配偶宫颈hr-HPV感染的男性外生殖器HPV感染状况研究发现,配偶宫颈HPV感染男性外生殖器HPV感染阳性检出率: 83.5%[15]。亚裔人种HPV感染率:42.2%[16] 。2016年南京医科大学附属妇产医院泌尿男科门诊调查了5个月(8月至12月)。配偶宫颈HPV 检测为阳性;近3个月内未应用免疫抑制剂139例女性的配偶。用尼龙棉签拭子在阴茎头、冠状沟、包皮内板、阴茎体等处取样,采用HPV分型检测试剂盒PCR 和膜杂交方法,检测不同型别HPV感染情况。阳性检出率在18~30岁组及51~63岁组分别高达97.6%和90%[15]。
这种男女性伴双方交互式重复感染,使hr-HPV感染转阴阻碍加大。特别对于女性性伴大大推迟了hr-HPV感染转阴时间,增加了hr-HPV持续感染的不良结果,提升了发展为宫颈高级别病变乃至宫颈癌的风险。
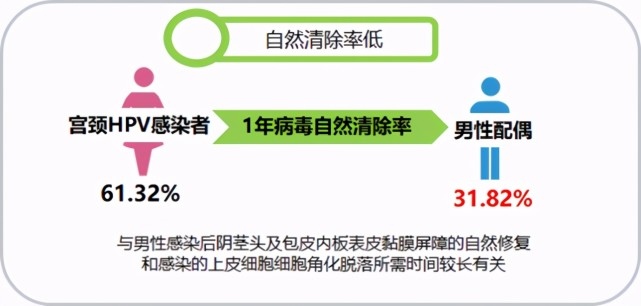
4.男女性伴感染同型别HPV一致性高且男伴自动清除率低
《国际医学检验杂志》中,关于高危型人乳头瘤病毒感染女性的配偶病毒跟踪检测结果分析显示[17],宫颈HPV感染者配偶1年病毒自然清除率为31.82% ,低于女性61.32%[18]的病毒清除率为。这与男性感染后阴茎头及包皮内板表皮黏膜屏障的自然修复和感染的上皮细胞细胞角化脱落所需时间较长有关。男方hr-HPV感染除对自身危害外,也增加了女方再感染或持续感染的几率和治疗难度。
5.男女性伴感染同型别HPV一致性高且持续感染时间长
176例年龄20~45岁配偶双方,HPV感染均阳性者。对宫颈HPV持续感染的配偶HPV感染型别的调查[19],结果显示共检测到21种亚型,型别一致率57.39%。在型别一致的101例中,hr-HPV16和hr-HPV18的一致率最高,分别是28.71%和27.72%。
进一步研究对246例,年龄28y~53y女性hr-HPV感染的配偶,跟踪检测hr-HPV,分别行外生殖器hr-HPV初检和一年后复检。结果显示:16、18型别阳性频次百分比分别是初检56.91%和复检70.00%,p<0.05。复测时hr-HPV16和hr-HPV18两型,所占型别频次阳性百分比明显升高,表明hr-HPV-16、18在男性伴中也具有持续时间长,自我清除较慢的特点[20]。
应用重组人干扰素α2b类凝胶,推广在会阴部、外生殖器或生殖道内使用,经由药物经济学研究评价证实[21],其3个月和6个月的HPV转阴率在70.06%和89.06%,无疑是在短时间内帮助hr-HPV宫颈感染的女性和性伴清除或及时阻隔hr-HPV感染的方法,是“男女性伴同防同治”是宫颈癌防治的重要环节,势在必行。
五、结束语
目前没有杀灭病毒的制剂及其治疗方法;初次感染和重复感染难以区分,引起易感者的恐慌;活动性感染与潜伏性感染之间无明显界限,导致感染者心理压力;感染早期、感染中期或长期感染鱼目混珠,资深大夫也伯仲难分;持续性感染的时间无绝对一致的定义(临床证据表明年轻女性自动清除的免疫功能未必100%,HPV致病毒力(hr-HPV16和18型与其他高危型别)不等);宫颈病变术后随访病毒转阴时限共识尚缺专家共识;宫颈癌根治术后随访局部HPV感染复发清除方法有限;HPV疫苗是宫颈癌一级防控措施不能取代二级防控;“男女性伴同防同治”是缩短HPV持续感染的重要环节!现阶段hr-HPV感染以无刺激型尤靖安干扰素凝胶行“男女性伴同防同治”属经典有效方法,不会造成男女性伴器官功能的损伤,若有效清除感染HPV,把握干预治疗的指征,无过度治疗嫌疑!
——【罗 新 述评 暨南大学附属第一医院妇科,广东,广州, 510630】
【参考文献】:
[1] 林仲秋,第25章子宫颈肿瘤,第1节子宫颈鳞状上皮内病变.《妇产科学》国家卫生健康委员会“十三五”规划教材,全国高等院校教材教材,主编:谢幸,孔北华,段涛. 人民卫生出版社. 2018年7月第9版,第1次印刷. p295-297
[2] 彭雪,胡丽娜. HPV感染及危险因素的研究[J].实用妇产科杂志2010,26(3):168
[3] Chesson H W, et al. Sexually Transmitted Diseases, 2014, 41(11):660.
[4] J Natl Cancer Inst 2008;100(7):513–7.
[5] WHO. Cervical Cancer Screening in Developing Countries. 2002
[6] WHO. Comprehensive Cervical Cancer Control A Guide to Essential Practice. 2006
[7] WHO. Preparing for the introduction of HPV vaccines: policy and programme guidance for countries. 2011
[8] WHO. Use of cryotherapy for cervical intraepithelial neoplasia.2011
[9] WHO. WHO guidelines for screening and treatment of precancerous lesions for cervical cancer prevention. 2013
[10] WHO Library Cataloguing-in-Publication Data Comprehensive cervical cancer control: a guide to essential practice – 2nd ed. 2014:1-364
[11] World Health Organization. Human papillomavirus vaccines: WHO position paper May 2014. Wkly Epidemiol Rec. 2014, 85, 465–492
[12] World Health Organization. Human papillomavirus vaccines: WHO position paper May 2017. Wkly Epidemiol Rec. 2017, 92, 241–268
[13] 中国《子宫颈癌综合防控指南》.中华预防医学会妇女保健分会.人民卫生出版社.2017年8月第1版
[14] Nick Mulcahy . Half of US Men Have Penile HPV, But What Does This Mean? , JAMA, May 15, 2017
[15] 潘连军,马洁桦,张峰磊,等.配偶宫颈HPV感染男性外生殖器HPV感染状况研究.中华男科学杂志. 2018,24(6):516-519
[16] Akogbe GO,Ajidahun Abidemi,Sirak B,et al. Race and prevalenceof human papillomavirus infection among men residing inBrazil,Mexico and the United States.Int J Cancer,2012,131(3):E282-E291
[17] 赵学英,刘学伟.高危型人乳头瘤病毒感染女性的配偶病毒跟踪检测结果分析.国际检验医学杂志.2017,38(17):2239-2341
[18] 张芳,陈英剑,胡成进.17-β 雌二醇对人卵巢癌细胞株HO8910KLK6 基因表达的调节[J].山东大学学报,2007,45(1):42-54.
[19] 徐鲁蒙,李光芝,王振华.女性宫颈HPV持续感染配偶HPV感染型别的调查.中国麻风皮肤病杂志.2018,34(1):36-37
[20] 赵学英,刘学伟.高危型人乳头瘤病毒感染女性的配偶病毒跟踪检测结果分析.国际检验医学杂志.2017,38(17):2239-2341
[21] 张学斌,管海静,刘国恩等.重组人干扰素a2b凝胶治疗高危人乳头瘤病毒感染的药物经济学评价.中国药物经济学.2019,14[10]:28-37

第九任暨南大学附属第一医院妇产科主任、教研室主任、妇科主任;第十任妇科主任;第十一任妇科主任、妇产科副主任。曾任第六代武汉大学人民医院妇产科主任、妇科主任,武汉大学第一临床学院妇产科教研室主任,第四任武汉大学医学院妇科研究室主任。
中国科学院优生科学协会中国宫颈癌与阴道镜专业委员会(CSCCP)常务委员;中国妇幼健康研究会宫颈癌防控专业委员会常务委员;“中国宫颈癌防治工程”项目组委会成员、项目特聘专家;中国抗癌协会肿瘤光动力治疗专业委员会全国委员,国家卫健委“生殖道感染诊疗技术专项能力培训”“生殖健康诊疗服务能力提升专项”国家级讲师;中国医师协会全国基层生殖道感染防治培训项目国家级培训师;中华预防医学会微生态分会妇产科学组委员;中国性学会第四届性医学专业委员会副主任委员;北京健康促进会宫颈病变与宫颈癌防治专家委员会副主任委员;北京市红十字基金会“同心共铸中国心”妇产科专家委员会广东省(市)分会副主任委员;广东省抗癌协会妇科肿瘤专业委员会委员;中国宫颈癌防治工程“生命之托,华夏同行”2018最美宫颈守护者“专业精英奖”;中国宫颈癌防治工程“生命之托,华夏同行”2019全国公益巡讲“传道受业奖”。获多项省级科研项目。国家自然基金面上项目1项,“十一五”“十二五”“十三五”科技支撑计划重点项目子课题各1项。科技部国家自然基金面上项目、地区合作项目和青年基金项目初评专家。科技部重大专项重点项目初评及二审会评专家。主编译、副主编译或参编译专著43部(篇章节)发表论文295篇,SCI和ISTP收录英文论文54篇和8篇。培养博士后1位,博士生19位,硕士生56位。




